Elemek, atomok röviden
Mi az atom?
Elektromosan semleges részecske, azért, mert a protonok (pozitív töltés) és az elektronok (negatív töltés) száma megegyezik bennük. Fő részei: atommag, elektronfelhő. Elemi részecskékből áll. A vegyjel felső részéhez: a tömegszám kerül (A), alsó részéhez a rendszám (Z).
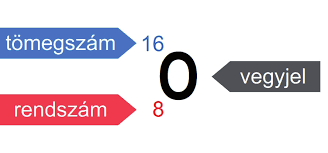
Mit határoz meg a tömegszám? (A)
Az atomok tömegét nem az elektronok száma fogja meghatározni, mivel az relatíve elhanyagolható. A tömeget a nukleonok (proton+neutron) határozzák meg. A két tömeg megközelítőleg azonos. Ennek köszönhető, hogy jól össze tudjuk hasonlítani az atomok tömegét. Tehát: tömegszám = ha összeadod a protonok+neutronok számának összegét:
A=Z+N, vagy A=P (proton) + N (neutron)
A=Z+N magyarázata:
Mit határoz meg a rendszám? (Z)
Megmutatja, hogy hol van periódusos rendszeren belül – tehát egy sorszám. (Az oxigén a 8. elem). Azt is, hogy hány db protont tartalmaz – vagyis az A=Z+N is helytálló (egyértelmű: A=Z vagy P + N), mivel a Z ugyanúgy a protonokat (is) jelöli <nem csak a lokalizációt>.
Mivel a protonok számát is mutatja a rendszám, az atom semlegességéből adódik még valami: megmutatja az elektronok számát. Ez azért logikus, mert a semlegességhez ugyanannyi pozitív töltésű részecske (proton+) kell, mint negatív töltésű részecske (elektron-).
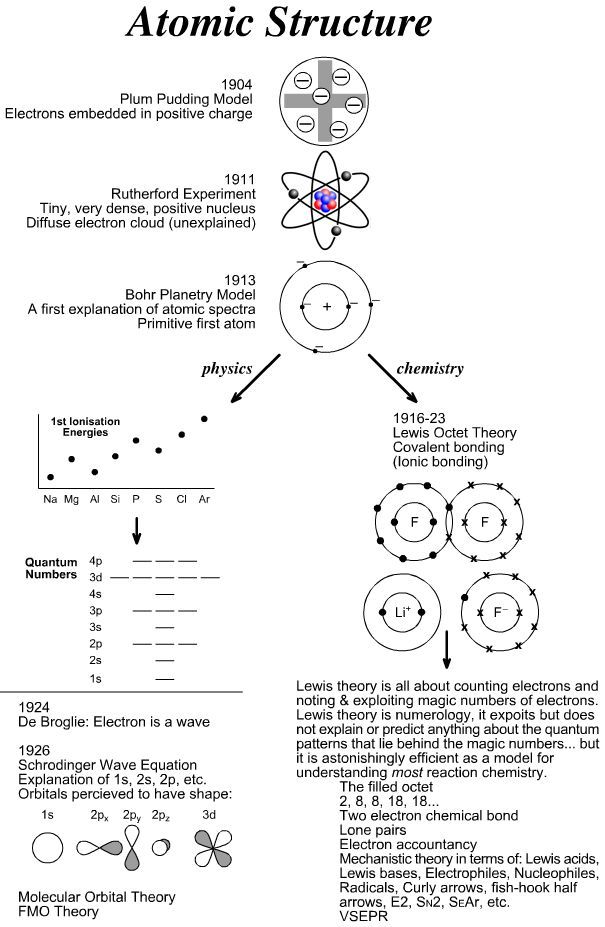
(1.)
Mi az elem?
Az azonos protonszámú atomok az elemek. Eltérhet: a tömegszám (A) – mivel a neutronszámuk eltérhet (nagy szerep az atomtömegben).
Elektronszerkezet, atommodellek:
(Az 1. ábrán látható az atommodellek fejlődése, különböző elképzelések. A számunkra fontos részek magyarázata a továbbiakban olvasható. Legfőképp Schrödinger matematikai modelljével foglalkozunk első körben, érintőlegesen.) (1.) A ma használatos atommodell szerint az elektronok az atommag körüli térben mozognak.
Miről lehet információnk az elektronnal kapcsolatosan?
Megadható az elektron:
- energiája
- megtalálási valószínűsége
- mágneses jellege
Nem adható meg:
- mozgásának pályája
Mi az atompálya?
Adott térrész atomon belül, melyben az elektron megtalálási valószínűsége 90%, továbbá a olyan felület a határa, amelyen mindenhol azonos az elektronsűrűség. Mit jelent ez? Az elektron létezik az atomon belül, atompályákon, atompályák elektronsűrűsége azonos.
Különféle pályák léteznek. Ezeket szimmetria jellemzi – például az s és a p esetében:
s-pálya (Sharp)
- gömbszimmetrikus
p-pálya (Principle)
- tengelyszimmetrikus
d-pálya: (Diffuse)
- centrálszimmetrikus
f-pálya: (Fundamental)
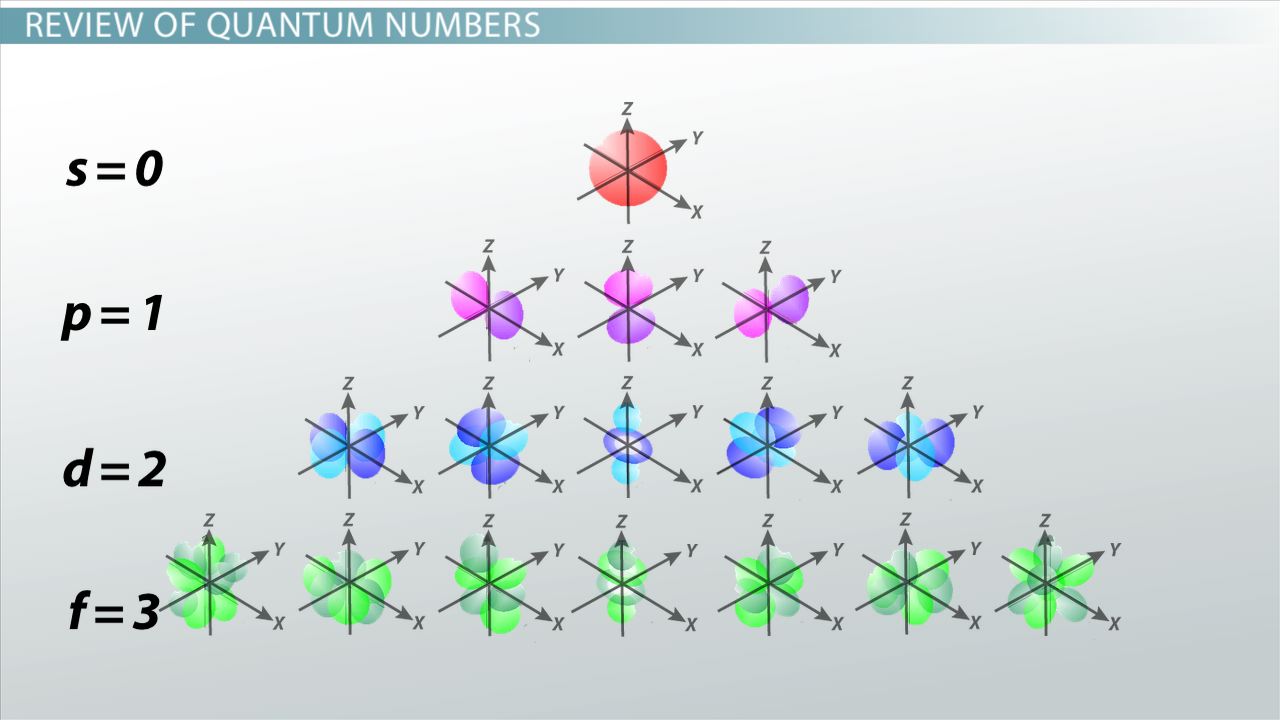
Kvantummechanikai atommodell megértéséhez hasznos ábra: (2.)
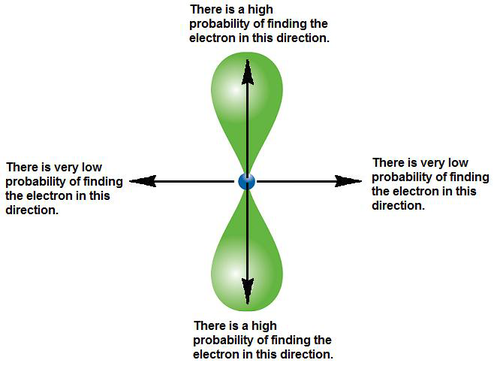
Megtalálási valószínűség könnyebb érthetőségét szolgáló ábra: (3.)
A pályák (s,p,d,f) szimmetriája, bal oldalon felsorakoztatva a mellékkvantumszámok l=0, l=1, l=2, l=3. (A mellékkvantumszám azért ilyen fontos ezen az ábrán, mivel a pályaszimmetriát határozza meg – de ez már a kvantummechanikai atommodell anyagrészhez fog tartozni.) (2.)
Írtam az elektron megtalálási valószínűségéről – ezt a következő ábrán könnyebb lehet megérteni: megmutatja, hol magasabb az elektron megtalálási valószínűsége (pontosabban, milyen irányban lehet magasabb). Látható az is, hol/milyen irányban alacsony ez a valószínűség. (3.)
Elektronfelhő héjszerkezete:
Léteznek az elektronfelhőn belül héjak és alhéjak. A hasonló szimmetriával rendelkező pályák alkotják meg az alhéjakat. A hasonló méretű és energiájú alhéjak adják a héjakat.
Az atompályán tartózkodó elektronra nem csak az jellemző, hogy negatív elektromos töltése van – hanem az is, hogy kétféle mágneses töltéssel rendelkeznek = SPIN.